

このページにはプロモーションが含まれています。
忙しくても利用しやすい理系学生・院生特化型就活サイト
ウェスタンブロッティングの転写効率確認方法と高分子量のコツ
ウェスタンブロッティングを行うとき、特にバンドが強くないときに気になるが
「ゲルからメンブレンへのタンパク質の転写効率は良いか?」
ということだと思います。
特に初心者の方は、(プレステインドの)分子量マーカーがメンブレンにきれいに移っているのを見て、「転写効率が良い」と思い込んでしまいがちです。
ですが、実は、分子量マーカーを見るだけでは、あまり転写効率の参考になりません。
分子量マーカーの色素はタンパク質そのものに比べ、かなりメンブレンに移りやすくなっているからです。
分子量マーカーのバンドは完全に移っているのに、かんじんのサンプルのタンパク質の転写効率はそれほど良くない、ということもあります。
ゲルからメンブレンへの転写効率を確認するためには、トランスファーの終わったゲルをCBBで染色し、ゲルがほとんど染まらないことを確かめましょう。
方法は次のとおりです。
- 転写の終わったゲルをタッパーウェアなどに入れ、CBB染色液で15-30分程度、室温で振とうさせる。
- CBB染色を除去し、ゲルを脱色液に浸け、余分なCBBがなくなるまで室温で振とうさせる。
- 脱色の際は、液中にキムワイプを1枚入れておく。そうすると、CBBの色素がキムワイプに吸着されるため、効率よく脱色が進む。キムワイプが青くなれば適宜交換する。
- 適当な頃合いを見計らい(オーバーナイトのことが多い)、脱色液を除去し、ゲルを蒸留水で洗浄する(酢酸臭がなくなるまで)。
- 洗浄の終わったゲルの画像を撮影する。
なお、CBB染色液のレシピはこちら⇒メンブレンCBB染色のプロトコル

このような感じで、ゲルの上にキムワイプを載せて振とうします。
そのうち、キムワイプが青く染まるので、新しいものと交換してください。
大抵の転写条件の場合、高分子量のバンドはゲル上で見えると思います。
これは高分子量タンパク質が完全にゲルから抜けきっていないことを表します。
セミドライ法のように弱い条件で転写を行った場合、低分子量のタンパク質も完全にはゲルから抜けきらず、全体的にバンドが観察されると思います。
下の画像はBio-Radのトランスブロットターボで転写した後のゲルをCBB染色したものです。
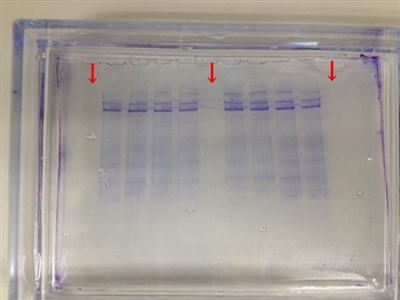
矢印で示したレーンは分子量マーカーが入っていたところです。非常によく抜けています。
ですが、細胞ライセートのレーンは、特に高分子量領域においてタンパク質がある程度残っているのが分かりますね。
低分子量領域ではわずかに残っていますが、大半は抜けていると言ってよいでしょう。
ただし、注意点として、ゲル上にタンパク質のバンドが観察されなかったからといって、全てメンブレン上に吸着されたことを意味しないということです。
ゲルからタンパク質が残っていないということと、メンブレンにタンパク質が吸着されるというのは別の現象です。
とはいえ、ゲルにタンパク質が残っていないことは、メンブレンへの転写が効率よく行われることの必要条件ですから、CBB染色で確認することは意味のあることです。
ゲルにCBB染色のバンドが残っていてはダメなのか?
ゲルからタンパク質が残っていれば絶対にダメというわけではありません。
検出されたバンドの定量性があまり問題ではないケースでは十分に使えます。
また、定量化が必要な場合でも、アプライしたタンパク質の量と目的のバンド強度との間に正の相関関係があれば定量してよいでしょう。
と言いますか、実際にメンブレン上に吸着されているタンパク質の量が問題で、メンブレンでの各レーン間での差がないことが大事です。
ただし、後述するように、高分子量のタンパク質だとセミドライ式では定量性に問題がある場合が出てきますので、転写効率を上げる方法を考えたほうが良いでしょう。
高分子量タンパク質も完全にゲルからメンブレンに転写させるには?
セミドライ方式であっても、条件によっては高分子量タンパク質のバンドを検出することは可能です。
ですが、転写効率が結構不安定であり、レーンごとのバンド強度を定量化するのは無理があると感じます。
そこで、私が400kDa以上のタンパク質をウェスタンで定量化したときの方法を参考までご紹介します。
- 転写バッファーは通常のトリス-グリシン-メタノールバッファーに0.1%SDSを加える(つまり1000mLのバッファーに対し1gのSDS)。
- 上記転写バッファーでサブマリン式(タンク式)で転写を行う。転写条件は30V(低電圧)で16時間。
- 発熱を最小限にするため、発泡スチロール箱にクラッシュアイスと水を詰め、その中にタンクを置いて転写を行う(氷が溶けてきて、転写中にタンク内に水が入らないように注意!)
転写バッファー中にSDSが含まれていると、ゲルからタンパク質が抜けやすくなります。
一方、SDSはタンパク質のメンブレンへの吸着を妨げますので、高すぎるSDS濃度は禁物です。
