Adipocyteに分化した3T3-L1細胞に蓄積した脂質を簡単に染色する方法としてold red O染色があります。
プロトコルは簡単であり、画像的にも油滴の蓄積が明確に分かるので、広く用いられている方法です。
また、画像撮影後は染料を溶媒に溶出させ、その吸光度を測ることで油滴の蓄積量を半定量化することもできます。
準備物
- オイルレッド O ストック溶液:30mgのオイルレッドOを10mLのイソプロパノールに溶かします(完全には溶けません)。 室温遮光保存します。
- 4%パラホルムアルデヒド(4%PFA):10%ホルムアルデヒドでも良いと思います。適当な固定液であれば何でもよいでしょう。
- ワットマンのろ紙(No.1)もしくは滅菌フィルター
- 60%イソプロパノール:イソプロパノールと蒸留水を3:2で混合。
- ヘマトキシリン溶液(核染色を行う場合)
プロトコル
6 wellディッシュに培養した場合を想定しています。
他のサイズの場合は、加える試薬量を適宜調節してください。
なお、反応は全て室温で行います。
- オイルレッドO染色液の作成:上記のストック溶液と蒸留水を3:2で混合し、ワットマンろ紙か滅菌フィルターでろ過し、沈殿を除去します。作成後は速やかに使用してください。
- 培地を除去し、PBSで細胞をリンスした後、1mL 4%PFAを加え、1時間インキュベーションする。
- 4%PFAを除去し、蒸留水で3回リンスする。
- オイルレッドO染色液を1wellに対して2mL加え、シェーカーでゆっくり振とうさせながら室温で20分インキュベーションする。
- 染色液を除去し、蒸留水2mL加えてリンスを5分間×3回。
- (核染色を行う場合はここでヘマトキシリン溶液で1分間染色し、蒸留水リンス5分間×3回)
- 60%イソプロパノール1mLでリンスを5分間×3回。
- ここで画像撮影を行う。
なお、オイルレッドO染色液を調製したら速やかに使わなければならないので、PFA固定が終わる少し前に調製するのがベストタイミングです。
![Oil Red O,オイルレッドO,染色,プロトコル,3T3-L1]()
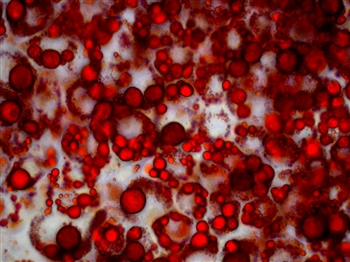
成熟脂肪細胞に分化させた3T3-L1 adipocyteのoil red O染色画像です。
油滴が鮮やかな赤色に染色させています。
![Oil Red O,オイルレッドO,染色,プロトコル,3T3-L1]()
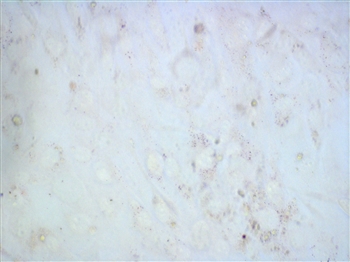
こちらは前駆細胞の3T3-L1 preadipocyteです。
ほとんど染まっていませんね。
なお、どちらもヘマトキシリン染色は施していません。
Oil red Oの半定量化プロトコル
- 100%イソプロパノール1mLを加え、5分間インキュベーションし、染色しているオイルレッドOを溶出させる。
- オイルレッドで呈色したイソプロパノールを200uL取り、96wellプレートに移す。
- マイクロプレートリーダーで吸光度を測定する(波長492nm)。
- なお、ブランクとして200uLのイソプロパノールを入れたウェルを作り、その吸光度も同時に測定すること。
各ウェルの実際の吸光度は次のとおり。
実際の吸光度=測定された吸光度 − ブランクの吸光度
- グラフ化する場合は、油滴量として表示することは難しい。
吸光度で表すか、対照群の吸光度に対する処置群の吸光度として相対値で表す。
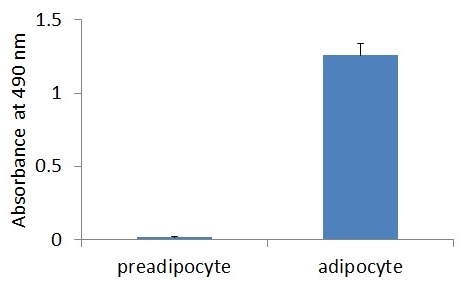
![Oil Red O,オイルレッドO,染色,プロトコル,3T3-L1]()
3T3-L1 preadipocyteとadipocyteの吸光度のグラフ。
※注意点
オイルレッドO溶液は、かなり染色力が強く、気をつけないとあちこちを赤く染めてしまいます。
気をつけないと結構悲惨にことになってしまいます・・・
吸い取るときは、1000uLマイクロピペットで注意深く吸い取り、廃液はまとめておくのが良いと思います。